Однажды древние люди начали применять естественные антибиотики задолго до их официального открытия. Они использовали травы, мёд и животные продукты для лечения различных недугов. Интересно, что порой самыми эффективными оказывались именно испорченные “лекарства”: плесневелый хлеб, скисшее молоко, стухшее мясо.
В древности люди инстинктивно прибегали к использованию естественных ресурсов, содержащих антибиотики.
Такие средства были особенно полезными, потому что они были насыщены плесенью, которая, применяясь на раны или употребляясь внутрь, обеспечивала защиту от вредных бактерий с помощью своих особых свойств.
Например, греки использовали плесневелый хлеб для обработки ран и лечения воспалительных процессов на коже, а в Древней Руси в этих же целях применяли тёплую землю.
В городе-герои Междуречье лекари подавали больным забродивший суп с черепашьими панцирями и змеиными шкурами, а болезни глаз лечили компрессами смесью лягушачьей желчи и кислого молока.
Только спустя века врачи и ученые осознали, что причина гнойных ран и многих заболеваний – невидимые для глаза существа (бактерии), которые могут попасть в организм с грязью на руках или медицинскими инструментами.
Бактерии были открыты голландским ученым Антони ван Левенгуком, который изобрел первый микроскоп.

Первый в мире микроскоп, придуманный Антони ван Левенгуком
Поиск средств для борьбы с бактериями побудил исследователей вновь вспомнить о древнем “лекарстве” и начать тщательно изучать целебные свойства плесени.
С XVII-го по XIX века британцы активно проводили эксперименты с различными видами плесени и выяснили, что на посевах, покрытых ею, не развиваются бактерии. А в 1897 году во Франции Эрнест Дюшен вылечил морских свинок от брюшного тифа с помощью плесени (Penicillium glaucum). Он разбавлял ее водой и вводил лабораторным животным.

Лечебная плесень Penicillum glaucum, с которой экспериментировал Эрнест Дюшен, до сих пор используется для производства сыра горгондзола
В различных уголках планеты исследователи обнаружили полезную плесень и применяли ее для лечения распространенных инфекций. И весьма успешно. Однако открытие антибактериальных свойств плесневых грибков было признано значительно позже.
Великое открытие Флеминга
В 1928 году сэр Александр Флеминг изучал в своей лаборатории в Англии бактерии семейства Staphylococcaceae (стафилококки). Учёный выращивал множество колоний в чашках Петри, а потом сделал паузу — уехал в отпуск. При этом посуду со своими экспериментами он не вымыл как следует, а какие-то чашки и вовсе простояли несколько недель нетронутыми.
Когда учёный вернулся, то заметил, что посевы покрылись плесенью, а вокруг плесневых «шапок» совсем не было бактерий.
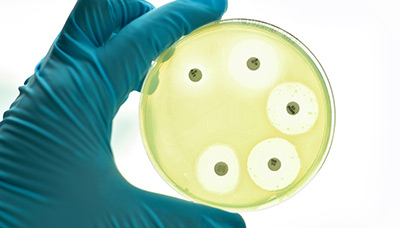
Плесень в чашке с колонией бактерий. Прозрачные круги — области, где действует пенициллин
Исследуя токсичную плесень, Флеминг распознал, что бактерии были уничтожены ее особым соком. Ученый назвал его пенициллином в честь гриба Penicillus, который уничтожил стафилококковые колонии.
Хотя Александру Флемингу не удалось выделить чистый пенициллин (в экспериментах использовался отфильтрованный бульон), он не смог определить вид исцеляющей плесени (спустя 2 года было обнаружено, что это Penicillium notatum). Однако он подробно описал ее воздействие на разные виды бактерий, сравнил различные виды плесени, и, главное, сохранил образцы, отправляя их заинтересованным коллегам.
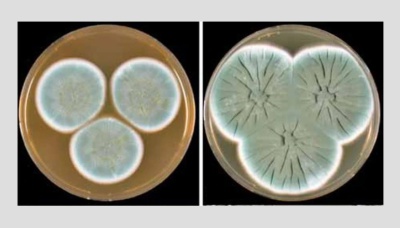
Грибковые скопления отряда Penicillus, с которыми занимался Флеминг. Изображение: Houbraken, J., Frisvad, J.C. & Samson, R.A
Один такой экземпляр хранился в Оксфордском университете почти 10 лет. В 1939 году ученый Эрнст Чейн выделил из него чистый пенициллин, а его научный руководитель Говард Флори успешно протестировал препарат на животных.
Петриевскую чашку, благодаря которой Флеминг сделал открытие, вместе с той самой плесенью в 2017 году продали на аукционе за 14 тысяч долларов.
Первым испытуемым стал 45-летний британский полицейский по имени Альберт Александр, который в декабре 1940 года поранился на шипе розы в своем саду, заразив рану стафилококковой и стрептококковой инфекцией. К моменту начала испытаний в феврале 1941 года его состояние было критическим, поскольку ни один из существующих методов лечения не помогал: инфекция распространялась по всему организму, лицо было покрыто гнойными язвами, а один глаз пришлось удалить.

Александр Флеминг в своей лаборатории
Уже в течение первых суток после введения пенициллина состояние Альберта значительно улучшилось: воспаление уменьшилось, температура вернулась к норме. Тем не менее, у ученых не хватало запасов препарата для завершения полного курса лечения.
Ученые производили очистку мочи пациента с целью получить даже самые маленькие капельки пенициллина. Однако этого оказалось недостаточно, и Альберт Александр скончался от сепсиса.
Несмотря на потенциальные преимущества использования пенициллина, британские фармацевтические компании не проявляли особого интереса к производству нового лекарства из-за большого количества заказов на оборону. Чтобы не дать открытию пойти на нет, ученые решили передать его американцам, но это было связано с большими рисками, так как такое инновационное лекарство могло повлиять на ход войны, и потому нельзя было допустить, чтобы оно попало в руки фашистов.
Для того чтобы доставить образцы плесени за границу, британцы придумали хитроумный план: они пропитали пальто грибными спорами и таким образом тайно перевезли открытие за океан.
Колонии грибов рода Penicillium в чашках Петри
В США вызвали огромный интерес к пенициллину, обнаружив родство с британской плесенью, производящей в 6 раз больше лекарства. Плесень начали выращивать в огромных емкостях и посылать на фронт. Окончание 1942 года запомнилось синтезированием менее 100 доз пенициллина в американских лабораториях, а к 1943 году уже было выпущено 21 миллиардов доз, а в 1945 – 6,8 триллиона доз.

Эрнст Чейн (слева) и Говард Флори (справа). Лауреаты Нобелевской премии по физиологии и медицине 1945 года (вместе с А. Флемингом)
После успеха пенициллина ученые по всему миру начали искать другие антибиотики. Так, в 1952 году в почве с острова Борнео обнаружили микроорганизмы Streptomyces orientalis и изолировали из них ванкомицин. Применение лекарства началось в 1958 году. В 1960-х годах появились цефалоспорины – усовершенствованные пенициллины, борющиеся с устойчивыми бактериями.
Благодаря открытию антибиотиков средняя продолжительность жизни между 1944 и 1972 годами увеличилась на 8 лет. Это в основном произошло потому, что дети и молодые люди перестали умирать от ранее неизлечимых инфекций.
Как антибиотики убивают бактерии
Антибиотики уничтожают бактерии двумя способами: разрушают клеточную стенку или генетический аппарат микробов.
Антибиотики, разрушающие клеточную стенку
Защитная клеточная стенка работает подобно доспеху, оберегая микроорганизм от воздействия разрушительных внешних факторов. Она помогает сохранять правильную форму клетки и регулирует уровень жидкости и питательных веществ внутри нее. Без этой клеточной защиты бактерии неспособны выжить при изменениях в уровне pH, водном балансе, температуре и других условиях.
В эту категорию входят различные классы антибиотиков, такие как β-лактамы (пенициллины, цефалоспорины, карбопенемы), гликопептиды (ванкомицин), полимиксины (колистин). Эти препараты применяются для лечения широкого спектра инфекций, включая гонорею, хламидиоз, некоторые кишечные инфекции и пневмонию.
Колистин считается одним из самых эффективных антибиотиков, он является лекарством “последней надежды”. Применяется он при лечении инфекций, вызванных устойчивыми госпитальными штаммами бактерий, а также в случаях, когда другие антибактериальные средства оказываются неэффективными.
Известно, что слово «антибиотик» формируется от греческих морфем ἀντί («против») и βίος («жизнь»).
Препараты, уничтожающие генетический аппарат бактерий
Некоторые средства против бактерий могут проникать в «сердце» микроорганизмов и нарушать процессы синтеза ДНК, передачи генетической информации, образования белков, необходимых для построения клеток. В результате бактерии теряют способность к росту и размножению.
К этому типу относятся тетрациклины, макролиды, фторхинолоны, сульфаниламиды. Их применяют при таких заболеваниях как туберкулез, туляремия, чума, бруцеллез, сепсис, раневые и ожоговые инфекции, а также другие инфекционные заболевания.
Имеется возможность применения антибиотиков разного спектра действия. Препараты узкого спектра направлены против ограниченного числа бактерий, например, только против стафилококков. Они рекомендуются для использования в случаях, когда известно, какой микроб вызвал инфекцию.
Препараты широкого спектра оказывают воздействие на множество видов бактерий, поэтому обычно назначаются, когда нет времени искать «виновника» инфекции, и необходимо начать лечение как можно скорее.
Помимо уничтожения патогенных бактерий, антибиотики также уничтожают представителей нормальной микрофлоры кишечника.
Критический сценарий: когда обойтись без антибиотиков невозможно
Препараты, которые применяются не только для борьбы с инфекциями, – это антибиотики. Применение антибактериальной терапии обычно встречается в различных областях медицины, таких как хирургия, неонатология, онкология и другие.
Методы борьбы с инфекциями
Благодаря антибиотикам смертность от раневых инфекций снизилась
Антибиотики действительно изменили ход медицинской практики: большинство болезней, связанных с вредоносными бактериями, перестали быть смертельными. Люди перестали так часто умирать от раневых, нейроинфекций, пневмонии, ИППП.
Ежедневно в мире заражается более 1 миллиона людей в возрасте от 15 до 49 лет ИППП. Применение антибиотиков способствует предотвращению летальных исходов от этих инфекций и их последствий.
Хирургия
Применение антибиотиков перед операцией является эффективным методом профилактики осложнений и позволяет сократить время восстановления
Любая операция, даже самая незначительная, как удаление фурункула, может стать опасной без использования антибиотиков. Потому что любая рана становится открытой дорогой для инфекции, так как бактерии или другие патогены могут проникнуть непосредственно в кровь, обойдя защитные системы организма.
Акушерство и неонатология

Заражения могут привести к гибели плода, замедлению его развития и врожденным дефектам. Применение антибиотиков способствует спасению и матери, и ребенка
Главными кандидатами на заражение инфекциями в родильном зале или в отделении реанимации являются ослабленные, недоношенные и дети, рожденные от инфицированных матерей. Однако даже здоровые младенцы, рожденные в срок, могут пострадать от тяжелых инфекций.
Их иммунная система только формируется, поэтому не может эффективно защищать от патогенных бактерий и других опасностей. Из-за этого уровень младенческой смертности до изобретения антибиотиков был очень высоким.
Кроме того, примерно 15–20% случаев родов по всему миру происходят с применением кесарева сечения. Для этого делается разрез брюшной стенки, чтобы безопасно извлечь младенца. Такая операция несет потенциальную опасность, поскольку через открытую рану могут проникнуть инфекции.
При осложненном течении беременности и угрозе разрыва плодных оболочек женщинам назначают профилактическую антибиотикотерапию для предотвращения серьезных инфекционных осложнений как у матери, так и у новорожденного. Без применения антибиотиков такая профилактика будет невозможна.
Операции при онкологических заболеваниях

Использование антибиотиков помогает ослабленной иммунной системе онкологических пациентов бороться с возможными инфекциями и их последствиями
Два самых распространенных метода лечения рака – химиотерапия и лучевая терапия – сильно ослабляют иммунную систему больных. Из-за этого организм становится уязвимым даже к относительно безвредным инфекциям, а контакт с бактериями может быть смертельным.
Поэтому пациентам, проходящим лечение от онкологического заболевания, могут назначать антибиотики в профилактических целях, чтобы избежать опасных последствий.
Трансплантология
Для предотвращения отторжения трансплантированных органов и тканей пациенты вынуждены принимать препараты, которые искусственно подавляют иммунную систему. Это приводит к таким же проблемам, как и при лечении рака: организм неспособен бороться с болезнетворными бактериями, вирусами и грибками. Без антибиотиков период адаптации трансплантата усложняется развитием инфекций.
Почему антибиотики перестают работать
В 1980-х годах не появилось ни одного нового класса антибиотиков, ученые лишь модифицируют уже существующие препараты. Это можно объяснить несколькими причинами. Среди них – достаточное разнообразие уже существующих лекарств и экономическая невыгодность производства антибактериальных препаратов.
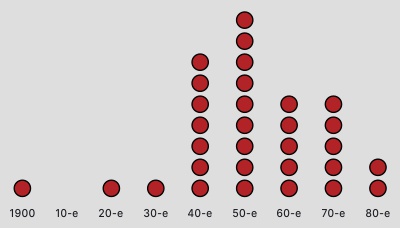
Количество разработанных антибиотиков в разные десятилетия ХХ века. Последний из них был открыт в 1984 году (по данным информационного агентства Bloomberg)
За последние две десятилетия многие крупные фармацевтические компании, такие как Johnson & Johnson, Roche, Pfizer, Eli Lilly and Company, Bristol-Myers Squibb, сократили разработку новых антибиотиков или полностью прекратили проекты в этой области. Это связано с появлением других востребованных и, в то же время, более прибыльных сегментов. Например, производство лекарств для лечения хронических заболеваний, таких как сахарный диабет, артериальная гипертензия, депрессия.
По средним данным, антибиотики начинают приносить прибыль лишь спустя 23 года после выпуска на рынок. Между тем на разработку одного нового препарата компании тратят около 1 миллиарда долларов.
Разработка нового препарата – это крайне дорогое мероприятие, так как, помимо проведения тестов в лаборатории, необходимо доказать его эффективность и безопасность на людях, пройти многочисленные проверки со стороны регулирующих органов. Только единицы из изученных молекул в конечном итоге поступают на рынок. После таких испытаний производящая компания, естественно, стремится получить прибыль.
Однако, учитывая, что бактерии очень быстро обучаются создавать устойчивость к новым препаратам, существует высокая вероятность того, что перспективный препарат вскоре станет неэффективным и прекратят его применение. В случае с препаратами для лечения хронических неинфекционных заболеваний риски значительно меньше.
Эволюция бактерий
Для того чтобы выжить, бактерии научились мутировать, то есть, приобретать новые способности, которые помогают им сопротивляться агрессивным факторам окружающей среды. Одни в ходе эволюции научились обходиться без кислорода, другие вырастили жгутики, с помощью которых могут передвигаться, третьи нарастили толстую «броню», четвертые вообще выработали ферменты, разрушающие антибиотики. И учитывая, что бактерии – короткоживущие организмы, выживающие за счет того, что стремительно размножаются путем простого деления, новые способности очень быстро наследуются потомками.
Процесс деления бактерий в благоприятных условиях очень интенсивный: в среднем каждый час у одной клетки появляется дочерняя копия.
За сутки у бактерии может появиться столько поколений «наследников», сколько родилось людей со времен Ивана Грозного.
Бактерии могут передавать полезные для выживания мутации как своим дочерним клеткам, так и друг другу. Этот процесс известен как горизонтальный перенос генов. Например, бактерии, развившие защитный механизм, могут передать его своим “соседям”, даже если они не родственники.
Флеминг обнаружил, что некоторые бактерии научились выживать при использовании пенициллина и других антибиотиков. С течением времени стало все сложнее разрабатывать новые лекарства против бактерий.
Почему антибиотикорезистентность делает человечество беззащитным перед инфекциями
В 1946 году выявили у 14% заболевших резистентность к пенициллину, а в 1950-м уже у 59%, а к 1990-му — у 95%, поэтому пришлось разрабатывать новые формулы и следующие поколения пенициллинов для успешного лечения. Сейчас ВОЗ называет устойчивость к антибиотикам одной из главных угроз для мирового здравоохранения. По мнению экспертов, каждый год из-за этого становится все сложнее бороться с пневмонией, туберкулезом, гонореей, сальмонеллезом и другими инфекциями.
Из-за устойчивости к антибиотикам ежегодно умирает 700 000 человек. Ожидается, что к 2050 году это число возрастёт до 10 миллионов. Другими словами, устойчивые бактерии приведут к большему количеству смертей, чем рак.
Список бактерий, устойчивых к антибиотикам:
- бактерия ацинетобактер (Acinetobacter baumannii),
- бактерия псевдомонады (Pseudomonas aeruginosa),
- микроорганизмы семейства энтеробактерий (Enterobacteriaceae),
- стрептококк энтерококка (Enterococcus faecium),
- стафилококк золотистый (Staphylococcus aureus),
- хеликобактер пилори (Helicobacter pylori),
- бактерия кампилобактер (Campylobacter),
- бактерия сальмонелла (Salmonella),
- дрожжеподобный гонококк (Neisseria gonorrhoeae),
- бактерия пневмококка (Streptococcus pneumonia),
- палочка гемофильной палочки (Haemophilus influenzae),
- бактерия шигелла (Shigella),
- бактерия клебсиеллы пневмонии (Klebsiella pneumonia),
- бактерия кишечной палочки (Escherichia coli),
- метициллинорезистентные штаммы стафилококка золотистого (MRSA).
Ежегодно примерно 250 тысяч человек умирают от туберкулеза, который стал устойчивым к антибиотикам.
Опасность резистентности
MRSA
Более полувека назад появились штаммы золотистого стафилококка, устойчивые к метициллину, известные как MRSA (Methicillin-resistant Staphylococcus aureus). Эти бактерии чаще других становятся невосприимчивыми к антибиотикам и ежегодно уносят жизни более 15 тысяч человек.
Энтерококки, устойчивые к ванкомицину, – частая причина госпитальных инфекций. В США ежегодно зарегистрировано около 66 тысяч случаев заражения подобными энтерококками.
Пневмококк Стрептококк пневмонии, который устойчив к амоксициллину и азитромицину, может вызвать тяжелое бактериальное воспаление легких и менингит. Резистентность усложняет лечение и приводит к семи тысячам смертей ежегодно.
Появление устойчивости бактерий – естественный процесс, однако эксперты утверждают, что человечество часто сами способствует ее формированию.
Бесконтрольное употребление антибиотиков
На протяжении десятилетий антибиотики были легкодоступными, поэтому люди использовали их для лечения самых разных заболеваний: от простуды до поноса. Это привело к появлению новых устойчивых бактерий, недостаточно чувствительных к существующим антибактериальным средствам.
Лекарства-антибиотики работают только против бактерий, поэтому они бесполезны против вирусных инфекций (если нет бактериального осложнения). Однако многие люди продолжают принимать антибиотики без настоящих показаний.
Нарушение схемы принятия антибиотика также способствует развитию устойчивости возбудителя. Часто пациенты принимают их недостаточно долго или в недостаточном количестве, они лечатся до уменьшения симптомов, а затем самостоятельно прерывают курс лечения. Бактерии в организме не уничтожаются полностью, но приобретают опыт взаимодействия с антибиотиками и развивают механизмы устойчивости.
Слишком низкая концентрация антибиотика не уничтожает бактерии, но позволяет им адаптироваться к препарату, как к неблагоприятному фактору, подобному холоду или ненормальному pH.
Зачастую антибиотики прописывают необоснованно не только при простуде, но и при многих других заболеваниях. Например, часто их используют в гинекологии и урологии. Одним из классических примеров является бессимптомная бактериурия, при которой в анализе мочи случайно обнаруживается большое количество патогенных бактерий. При этом человека ничто не беспокоит.
Часто у таких пациентов при необходимости прописывают антибиотики для излечения воспаления, однако это лечение не влияет на качество жизни человека, зато хорошо “тренирует” бактерии. Последние исследования показывают, что бессимптомная бактериурия является одним из видов комменсализма (безвредное соседство бактерий в организме хозяина). Она может быть даже полезной для поддержания перекрестного иммунитета к другим бактериям. Поэтому многие специалисты утверждают, что такое состояние не нуждается в лечении, если не проявляется симптомами (принцип “не лечить анализы”). Пациентов с бессимптомной бактериурией рекомендуется наблюдать в динамике.
В развитых государствах антибиотики редко доступны без рецепта врача, однако бактерии все равно становятся устойчивыми. Частично виноваты в этом страны, где такие препараты можно свободно купить. Эта проблема актуальна, например, для Индии, где в 2020 году было продано около 216 миллионов избыточных доз антибиотиков.
Индия — лидер по доле устойчивых штаммов бактерий. Более 50% образцов клебсиеллы пневмонии здесь устойчивы к карбапенемам, препаратам широкого спектра действия.
Общемировое потребление антибиотиков с 2000 по 2010 год выросло больше чем в три раза. В основном за это ответственны пять стран — Бразилия, Россия, Индия, Китай и Южно-Африканская Республика (БРИКС).
Один из важных аспектов, на который стоит обратить внимание, это безопасное использование пенициллина. Необходимо понимать, что пенициллин не имеет токсичного воздействия в любых дозах, и не нужно бояться передозировки. Опасность скрыта именно в малых дозах. В лабораторных условиях легко создать устойчивые к пенициллину микроорганизмы, выдерживая их в концентрациях, которые не могут их уничтожить, и то же самое может случиться и в вашем организме.
Скоро настанет время, когда любой сможет легко приобрести пенициллин. И здесь есть опасность, что недосведченный человек может случайно принять недостаточную дозу и вырастить в своем теле микроорганизмы, устойчивые к пенициллину, под влиянием низких концентраций препарата» (А. Флеминг)
Развитие сельского хозяйства
Было известно, что антибиотики необходимы не только для людей, но и для бизнеса. Внедрение антибиотиков в животноводство позволило успешно лечить животных, поддерживать благополучную эпидемиологическую обстановку и обеспечивать безопасность продуктов животноводства для людей. Примечательно, что используются для этого антибиотики из тех же групп, которыми лечат инфекции у людей.

Не менее половины всех производимых антибиотиков используется в сельском хозяйстве
Таким образом, бактерии, приобретающие устойчивость в организме животных, могут заразить и человека: через прямой контакт, окружающую среду или продукты (молоко, яйца, мясо).
Часто специалисты Роспотребнадзора выявляют антибиотики при проверке молочной и мясной продукции: сметаны, кефира, полуфабрикатов из птицы и свинины.
В действительности применение антибиотиков для лечения животных не так уж плохо, важно соблюдать правила безопасности. После лечения и в течение нескольких недель животное должно “отдохнуть”: мясо и другие продукты, получаемые от него, не должны использоваться в производстве. За это время антибиотики выводятся из организма. Но это временное препятствие, что означает потерю доходов. Некоторые фермеры не соблюдают такие меры предосторожности, и в результате на прилавках оказываются насыщенные антибиотиками продукты.
Кроме обычных продуктов животного и молочного происхождения, антибиотики также содержатся в мясе рыбы и некоторых морепродуктах. Оказалось, что вода в каналах Санкт-Петербурга обладает выраженным антибактериальным действием. Это связано с тем, что антибиотики попадают в нее из очистных сооружений.
Как следствие, скользкие водоросли в водоемах потеряли защитный слой слизи. В новых условиях он им просто не нужен, ведь они плавают в растворе антибиотиков.
Небольшие количества антибиотиков даже обнаружены в меде. Специалисты высказали предположение, что пчеловоды могут использовать лекарства для профилактики и лечения аскосфероза – инфекционного заболевания, поражающего личинок трутней и молодых пчел.
Супербактерии
Супербактерии – это микроорганизмы, которые приобрели устойчивость ко всем известным антимикробным препаратам. Это явление было отмечено недавно.
В 2008 году в регионе Индо-Пакистана были обнаружены случаи заражения людей бактериальной инфекцией, которая не реагировала на любые антибиотики. Хоть случаи были единичными, но сам факт полирезистентности насторожил врачей и ученых.
К 2010 году стало известно, что штаммы супербактерий распространены по всему миру. Это, вероятно, связано с поездками людей в страны Индо-Пакистанского региона, откуда они и привозят опасные бактерии.
Возвращение из путешествия в Индию стало трагедией для 70-летней американки в 2016 году. Несчастный случай в поездке привел к перелому ноги, после чего женщина оказалась в местной больнице, где заразилась супербактерией Klebsiella pneumoniae. После возвращения домой началось сильное воспаление, и даже все доступные антибиотики не смогли помочь спастись жизни пациентке. От септического шока женщина скончалась.
Позже подобные случаи заражения были выявлены и в других странах – в Швеции, Бельгии, США, Канаде, Великобритании. Специалисты отмечают, что большинство инфицированных контактировали с бактерией в медицинских учреждениях.
В больницах широко используют антибактериальные препараты и антисептики, из-за чего бактерии становятся устойчивыми к большому количеству препаратов и быстро распространяются среди пациентов и медперсонала.
Пути преодоления антибиотикорезистентности
У каждой страны существуют свои методы решения этой проблемы. Например, в Евросоюзе с 2006 года запрещено применение антибиотиков в кормах для животных. В России с 2017 года ограничено использование антибактериальных препаратов: их продажа без рецепта врача в аптеках запрещена. В феврале 2018 года ВОЗ опубликовала рекомендации по борьбе с антибиотикорезистентностью для всех участников процесса лечения: пациентов, врачей, фармацевтов, представителей власти, фармацевтических компаний и сельского хозяйства.
Основные правила преодоления антибиотикорезистентности для пациентов:
- Следует принимать антибиотики только по рекомендации врача и завершать весь курс лечения;
- Не стоит делиться оставшимися антибиотиками с другими людьми;
- Важно мыть руки и соблюдать правила гигиены при приготовлении пищи;
- Необходимо исключить или уменьшить контакты с больными;
- Рекомендуется практиковать безопасный секс;
- Важно пройти вакцинацию в полном объеме.
Для медиков разработаны правила разумного применения антибиотиков – это ежегодно обновляемые справочники, в которых указано, как, когда и в каком объеме следует назначать антибиотики. Например, при бактериальной инфекции Х следует начать с препарата А, если он неэффективен, то через определенное время применить препарат Б, а только потом препарат В. Препараты второй и последующих линий стараются применять только в случае крайней необходимости.
Обычно вначале назначают антибиотик широкого спектра, а затем (после получения результатов анализа на чувствительность к антибиотикам) можно перейти к препарату с более узким спектром действия. В случае недостаточной эффективности применяют комбинацию антибиотиков.
Препараты первой линии обычно легче переносятся, стоят дешевле и имеют обширную доказательную базу. При нерациональном применении антибиотиков существует риск перехода на препараты второй линии, и, в конечном итоге, на самый последний рубеж, после которого не останется ничего.
Выбрать антибиотик, который с 99% вероятностью поможет победить бактерию, можно только на основе результатов анализа с определением чувствительности к антибиотикам.
Альтернативы антибиотикам
Для профилактики инфекционных заболеваний существуют также альтернативы антибиотикам.
Как бороться с инфекционными заболеваниями:
- пассивная защита (введение готовых антител);
- активная защита (прививки);
- терапия фагами (лечение с помощью вирусов, таких как бактериофаги);
- использование антисептиков.
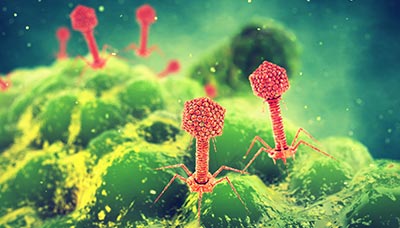
Бактериофаги – это вирусы, которые уничтожают бактерии, но не наносят вреда другим организмам
Одним из наиболее перспективных методов лечения является фаговая терапия. Каждый вид бактериофагов (а их миллионы) действует эффективно только против своего вида бактерий. В отличие от процесса, подобного антибиотикорезистентности, при их взаимодействии с микробами такого не возникает, поскольку бактериофаги – это вирусы, и они также способны изменяться. Когда бактерия адаптируется и обретает устойчивость, фаг может найти к ней новый “ключ” и добиться своего.
Как и антибиотики, бактериофаги относятся к антибактериальным препаратам. В целом они выполняют одну и ту же функцию – уничтожают бактерии, хотя делают это по-разному. Однако бактериофаги не могут полностью заменить антибиотики, так как каждый вид фага действует против конкретной бактерии. Тем не менее, в большинстве случаев пациенту необходима антибактериальная терапия на этапе, когда возбудитель еще не установлен.
Пока нет достаточного количества авторитетных исследований, которые подтверждали бы эффективность и безопасность фаговой монотерапии.
Чтобы улучшить результаты противомикробной терапии и предотвратить антибиотикорезистентность, бактериофаги начали применять в сочетании с антибиотиками. Исследования показали, что их совместное действие превосходит сумму эффектов каждого препарата по отдельности.
Возможно ли остановить распространение антибиотикорезистентности?
До сих пор антибиотики остаются самым эффективным средством для лечения бактериальных инфекций и каждый день спасают миллионы жизней, пока они продолжают действовать. Но если люди используют антибиотики без необходимости и не соблюдают меры предосторожности, они способствуют развитию и распространению антибиотикорезистентности. В итоге страдают все: пациенты проводят больше времени в больнице, государство тратит больше денег на медицину, а люди умирают чаще от бактериальных инфекций и их последствий.
Поэтому для того чтобы сохранить эффективность антибиотиков и не вернуться в Средневековье с его смертельными эпидемиями, каждый должен бережно относиться к антибактериальной терапии: принимать антибиотики только по назначению врача, следовать строго прописанному курсу лечения и не употреблять их про запас. Нарушая эти правила, человек не только способствует распространению антибиотикорезистентности, но также рискует ухудшить течение своей инфекции и увеличить вероятность возникновения потенциально опасных побочных эффектов в десятки раз.
Влияние использования антибиотиков на микробиому
Научные исследования показывают, что применение антибиотиков может приводить к дисбалансу в микробиоме, что в свою очередь может вызывать различные заболевания и ухудшение общего состояния здоровья. Это связано с тем, что использование антибиотиков уничтожает как патогенные, так и полезные микроорганизмы, что может привести к появлению супербактерий – штаммов, обладающих высоким уровнем устойчивости к антибиотикам и представляющих серьезную угрозу для общественного здоровья.
- Методы лечения инфекций
- Борьба с антибиотикорезистентностью
- Новые стратегии в лечении болезней
Новейшие технологии в борьбе с антибиотикорезистентностью
Одним из ключевых направлений в борьбе с антибиотикорезистентностью является использование методов генетической инженерии. С помощью современных технологий ученые могут создавать новые антибиотики, которые будут более эффективными и менее подверженными резистентности.
Другим важным инструментом является использование технологий информационной медицины. Благодаря анализу больших данных о распространении резистентных штаммов бактерий, врачи могут быстрее и точнее подбирать лечение для конкретного пациента, минимизируя вероятность развития резистентности.
Также стоит отметить значимость световой терапии и использования наночастиц в лечении инфекций. Эти технологии позволяют уничтожать бактерии без применения антибиотиков, что помогает снизить риск возникновения резистентности.
Информирование населения об опасности резистентности, а также о доступных методах профилактики и лечения, также играет важную роль в борьбе с этой проблемой. Создание образовательных программ и распространение информации о новейших технологиях помогут повысить осведомленность людей и сделать более эффективными меры противодействия антибиотикорезистентности.
Роль образования и информирования населения в противодействии резистентности
Для снижения уровня антибиотикорезистентности необходимо проводить образовательные мероприятия, направленные на повышение осведомленности населения. Подобные мероприятия могут включать проведение лекций, семинаров, круглых столов, обучающих мероприятий, а также публикации в печатных и электронных СМИ о проблемах использования антибиотиков.
Важным шагом в борьбе с антибиотикорезистентностью является сотрудничество медицинских работников с образовательными учреждениями и общественными организациями. Вместе они могут принимать меры по информированию населения о правильном использовании антибиотиков, а также о необходимости соблюдения предписаний врачей при лечении инфекционных заболеваний.
Кроме того, для успешной борьбы с антибиотикорезистентностью необходимо проводить кампании по повышению осведомленности населения о проблеме резистентности и ее последствиях. Особое внимание следует уделить молодежи, как будущему поколению, чтобы с их помощью сформировать правильное отношение к использованию антибиотиков и принятию мер по предотвращению резистентности.
Глобальное согласованное действие против эпидемии антибиотикорезистентности
Мир столкнулся с серьезной угрозой в виде эпидемии антибиотикорезистентности, когда микробы становятся устойчивыми к действию антибиотиков. Для того чтобы противостоять этому явлению, необходимо разработать и внедрить глобальные стратегии и действия, которые будут координированы на мировом уровне.
| 1. Создание общих стандартов | Необходимо разработать единые стандарты по использованию антибиотиков, чтобы исключить их неправильное применение и повысить эффективность лечения. |
| 2. Международное сотрудничество | Важно установить сотрудничество между странами для обмена информацией о распространении резистентных штаммов и разработке общих программ по борьбе с антибиотикорезистентностью. |
| 3. Образование и информирование | Пропаганда знаний о правильном использовании антибиотиков среди населения и медицинского персонала играет ключевую роль в предотвращении распространения резистентных микробов. |
Глобальное согласованное действие является необходимым условием для успешной борьбы с эпидемией антибиотикорезистентности. Только объединенные усилия могут привести к положительным результатам и обеспечить сохранение эффективности антибиотиков для будущих поколений.
Видео по теме:
Вопрос-ответ:
Почему древние цивилизации использовали испорченные продукты для лечения?
Испорченные продукты содержат микроорганизмы, которые могли иметь антибактериальное действие, что помогало в борьбе с инфекциями и заболеваниями.
Какие именно продукты использовались для лечения в древности?
Для лечения в древности использовались травы, мёд, животные продукты, а также испорченные продукты, такие как плесневелый хлеб, скисшее молоко, стухшее мясо.
Почему испорченные «лекарства» оказывались более эффективными?
Испорченные продукты содержат бактерии и грибы, которые могут обладать антибактериальными свойствами и помогать в лечении инфекций.
Каким образом древние цивилизации использовали испорченные продукты для лечения?
Древние цивилизации могли употреблять испорченные продукты в пищу или наносить их на раны для лечения инфекций и других заболеваний.
Существуют ли современные научные исследования, подтверждающие эффективность испорченных продуктов в лечении заболеваний?
Существуют исследования, которые показывают, что некоторые плесневые и гнилые продукты содержат вещества с антибактериальным действием, что может быть полезно в лечении определенных заболеваний. Однако, необходимо помнить о возможных побочных эффектах и рисках употребления испорченных продуктов.