Иммунитет – это сложная система органов и тканей, которая защищает наш организм от различных болезнетворных вредителей. Эта защита начинается еще до рождения, на 13-й неделе внутриутробного развития. Важные элементы иммунной системы включают в себя лимфатическую систему, тимус, костный мозг, вилочковую железу, миндалины, аппендикс и селезенку. Костный мозг производит лимфоциты – особые белые кровяные клетки, которые не только уничтожают патогены, но и синтезируют антитела. Антитела, или иммуноглобулины, являются специальными белками, производимыми В-лимфоцитами, и помогают нейтрализовать патогены, попадающие в организм. Они могут самостоятельно уничтожать вирусы и бактерии, либо привлекать другие элементы иммунной системы, такие как клетки-фагоциты и ферменты.
Иммунитет может быть врожденным или приобретенным. В результате использования своих лимфоцитов и антител, полученных от матери, организм младенца с самого начала жизни способен нейтрализовать патогены. Приобретенный иммунитет развивается после перенесенного инфекционного заболевания или вакцинации. Иммунная система “запоминает” патоген и при следующем контакте с ним быстро производит антитела, которые уничтожают агрессора. Отражение атаки патогенов с помощью лимфоцитов называется клеточным иммунитетом, а защита антителами – гуморальным иммунитетом.

Вакцинация – один из самых надежных способов формирования иммунитета против инфекций
Процессы, связанные с работой органов иммунной системы, включая синтез защитных клеток и антител, являются сложными и многоэтапными. Сбой в функционировании любого из них может привести к иммунодефицитному состоянию.
Понятие первичного иммунодефицита
Существует около 450 форм врожденных нарушений иммунитета, или врожденных ошибок иммунитета, как эти состояния стали называться в последние годы. Первичный иммунодефицит обусловлен генетическими дефектами и проявляется у ребенка почти сразу после его рождения или в младенческом возрасте. Вследствие дефектов в работе иммунной системы организм становится неработоспособным в борьбе с вирусами и бактериями, что приводит к тяжелым заболеваниям, таким как ОРВИ, бронхиты, пневмонии, отиты и синуситы у детей с первичным иммунодефицитом. У них также отмечается быстрое развитие различных воспалительных процессов, аллергических реакций, аутоиммунных заболеваний и раковых опухолей.
По мнению некоторых ученых, первичный иммунодефицит диагностируется только у одного из десяти тысяч человек. Однако они считают, что это число занижено из-за множества неучтенных случаев. По их оценкам, в мире должно быть около шести миллионов людей с angeborenen Immunschwächen. В России количество подтвержденных случаев этого заболевания составляет всего 3,5 тысячи, но, вероятно, людей с первичным иммунодефицитом в стране гораздо больше.
Причины появления первичного иммунодефицита
Основной причиной возникновения первичного иммунодефицита является изменение генов, которое передается по наследству от одного или обоих родителей или возникает спонтанно. Чаще всего ПИД наследуется по аутосомно-рецессивному типу (когда ребенок получает по одной копии поврежденного гена от каждого из родителей) или Х-сцепленному типу (дефективный ген передается мальчику от его матери). Специалисты обнаружили более 300 генов, мутации в которых приводят к этим заболеваниям.
Также считается, что врожденные нарушения иммунитета могут возникнуть из-за инфекций, которыми ребенок заразился внутриутробно от матери (краснуха, герпес, токсоплазмоз, цитомегаловирус). Во многих случаях причина сбоя, приведшего к ПИД, остается неизвестной.
Классификация первичного иммунодефицита
Многие медики и специалисты ориентируются на классификацию, предложенную комитетом экспертов по первичным иммунодефицитам Международного союза иммунологических обществ. Согласно этому подходу в редакции 2019 года, врожденные нарушения иммунитета подразделяют на 10 категорий.
Комбинированные иммунодефициты
Сюда относятся прежде всего тяжелые комбинированные иммунодефициты (ТКИН), которые встречаются преимущественно у мальчиков. При таких нарушениях в организме практически отсутствуют некоторые виды лимфоцитов — Т-клетки, а также в некоторых случаях — В-клетки и NK-клетки. Эти заболевания проявляются в первые недели или месяцы жизни ребенка диареей, кандидозами, ОРВИ, пневмониями и другими инфекциями, а также аутоиммунными заболеваниями и нарушениями метаболизма. Для них характерны бесконечные рецидивы и атипично тяжелое течение: например, цитомегаловирусная инфекция, которая у здорового человека чаще всего проходит бессимптомно, у таких детей вызывает осложнения в виде пневмонии и гепатита. Им необходима пересадка костного мозга.
Группа ПИД, связанных с симптомами синдромов
Сюда относятся синдромы Смита-Лемли-Опица, Менделя, Грисели, Блума-Снайдера, Локшена, а также синдром изощренной иммунодефицитности А. Генетическое нарушение вызывает не только нарушение иммунной системы, но и различные аномалии (интеллектуальная отсталость, скелетные дефекты, восприимчивость к онкологическим и сердечно-сосудистым заболеваниям). У детей с такими синдромами функционируют хуже белки иммунной системы, обычно им назначают профилактический прием антибиотиков, противогрибковых и противовирусных средств, вводят иммуноглобулин. При синдромах Смита-Лемли-Опица и Менделя также рекомендуется трансплантация костного мозга.
Главным образом иммунодефициты связаны с нарушением гуморального иммунитета
Среди них можно выделить общую вариабельную иммунную недостаточность и болезнь Брутона. При таких заболеваниях нормально функционируют Т-клетки, но практически отсутствуют В-клетки, вследствие чего иммунная система не способна синтезировать антитела. Обычно подобные состояния проявляются у ребенка через несколько месяцев после рождения, когда количество антител, переданных от матери, снижается. Пациенты с дефектами в иммунной системе часто подвержены инфекциям (ОРВИ, ротавирус, гепатиты), могут иметь нетипичные реакции на прививки, развить аутоиммунные заболевания, злокачественные опухоли. Для таких детей рекомендуется профилактически вводить иммуноглобулин и назначать антибиотики при инфекциях.
Поражение иммунитета с дисфункцией
При наличии таких заболеваний из-за нарушений в генах происходит дисбаланс в работе иммунной системы. С одной стороны, она становится излишне активной, что приводит к автоиммунным заболеваниям, при которых поражаются органы и ткани собственного организма. С другой стороны, нарушается защитная система от внешних патогенов. Пациентам с такими формами ПИД назначаются препараты, которые сдерживают излишнюю активность иммунной системы, а также антимикотики и антибиотики для борьбы с инфекциями.
Наследственные дефекты количества и функций фагоцитов (клеток, поглощающих патогенные микроорганизмы)
Некоторые заболевания из этой группы включают в себя нейтропении и болезнь, известную как хроническая гранулёматозная болезнь (ХГБ). Пациенты с этими заболеваниями часто сталкиваются с инфекциями, анемией и воспалительными процессами в лёгких, печени, лимфатических узлах и ЖКТ. Лечение включает в себя приём антибиотиков, противогрибковых средств и иммуномодуляторов. Для многих пациентов с ХГБ рекомендуется трансплантация костного мозга.
Дефекты врождённого иммунитета
Эти заболевания характеризуются нарушениями в механизмах защиты от вирусов, а также дефицитом лимфоцитов и антител. Это делает организм уязвимым перед микобактериями (вызывающими бронхит, туберкулёз, хронические заболевания лёгких) и вирусными инфекциями. Для лечения этих заболеваний рекомендуется антибактериальная терапия и введение иммуноглобулина.
Аутоиммунные синдромы
У людей, страдающих от подобных синдромов, иммунная система чрезмерно реагирует на любое раздражение. Например, при таких заболеваниях температура повышается, и воспалительные процессы возникают даже без наличия инфекции. Для лечения автоиммунных синдромов применяются лекарства, которые подавляют активность определенных клеток иммунной системы.
Нарушения работы системы комплемента
Система комплемента — это часть иммунной системы, которая содержит ферменты, необходимые для эффективной борьбы с инфекциями. Если происходит нарушение в образовании этих ферментов или их функционировании, организм хуже справляется с инфекциями, что часто приводит к воспалениям и развитию аутоиммунных заболеваний. Одним из серьезных проявлений дефектов комплемента является наследственный ангионевротический отёк подкожной клетчатки и слизистых оболочек (отёк Квинке). Это состояние, опасное для жизни, возникает без видимых причин у людей с иммунодефицитом. При данном заболевании пациенту могут вводить недостающие ферменты, проводить переливание плазмы крови и, при необходимости, использовать антибактериальную терапию.
Недостаточность костного мозга
Сюда относятся заболевания, связанные с нарушением процесса образования крови. Сюда входят различные формы анемии Фанкони, врожденные дисцератозы и синдромы дефицита костного мозга. В зависимости от типа и степени тяжести заболевания, пациентам назначают средства для стимуляции образования крови, проводят переливание необходимых компонентов крови и выполняют пересадку костного мозга.
Фенокопии первичных иммунодефицитов
Сюда попадают все перечисленные выше состояния иммунодефицита. Они выделяются в отдельную группу, так как возникают вследствие случайной мутации и не могут быть унаследованы.
Признаки первичного иммунодефицита
Большинство случаев первичного иммунодефицита проявляется в первые недели или месяцы жизни, однако эти состояния часто остаются нераспознанными, так как приписываются младенческой незрелости иммунитета.

По оценкам экспертов, от 70 до 90% случаев первичного иммунодефицита остаются недиагностированными
Синдромы, входящие в обширную группу ПИД, могут сопровождаться различными симптомами, но иммунологи выделяют несколько признаков, по которым можно подозревать врожденные ошибки иммунитета.
Основные признаки первичного иммунодефицита:
- частые инфекционные заболевания и воспалительные процессы: более восьми гнойных отитов, два или более тяжелых синусита, две или более пневмонии в течение года;
- генерализованная форма заболеваний (инфекции быстро охватывают множество органов и систем организма), атипичное течение заболеваний;
- низкая чувствительность к антибактериальной терапии: требуется длительное (более 2 недель) применение антибиотиков или их внутривенное введение;
- нарушение пищеварения, длительная диарея с потерей веса;
- частые абсцессы (гнойные воспаления) кожи или других органов, грибковые инфекции слизистых оболочек и кожи (кандидозы);
- повышенная температура тела без других признаков инфекции или, наоборот, необычное отсутствие жара при сильном воспалительном процессе;
- аутоиммунные заболевания, дефекты сердца, ЖКТ, скелета;
- серьезные и необычные осложнения после вакцинации и хирургических вмешательств.
Если у детей появились два или более признака из описанного выше списка, то следует обратиться к врачу для исключения или подтверждения первичного иммунодефицита.
Специалисты, занимающиеся лечением первичного иммунодефицита
Для диагностики и терапии первичного иммунодефицита необходимо обратиться к аллергологу-иммунологу. При необходимости для выявления причин и формы ПИД может потребоваться помощь генетика, а для лечения сопутствующих заболеваний – консультация андокринолога, инфекциониста, педиатра и дерматолога. На встрече с врачом важно предоставить информацию о жалобах, анамнезе болезни и развитии ребенка, а также семейном анамнезе. На основе этих данных формируется план обследования, который может включать лабораторные (в том числе генетические тесты) и инструментальные исследования.
Лабораторная диагностика
Анализ крови помогает выявить снижение уровня лейкоцитов.
В результате биохимического анализа крови возможно обнаружить недостаток белка при иммунодефиците.
Для выявления ПИД проводится исследование антител класса М, G и А, оценивающее работу гуморального иммунитета, а также различные виды лимфоцитов для определения эффективности клеточного иммунитета.
Для подтверждения диагноза и выявления причин иммунодефицитного состояния проводят молекулярно-генетический анализ. Если есть подозрения на конкретную форму ПИД, то делают исследование генов, которые отвечают за эту ошибку в иммунитете. В случае если мутация не определена, требуется проведение полного экзомного или полного геномного секвенирования для уточнения формы ПИД. Экзомное секвенирование – это исследование, которое помогает расшифровать гены, кодирующие белки, а геномное секвенирование – более детальный тест, который анализирует также “молчаливые” области генома, не участвующие в кодировании.
Изучение ДНК TREC и KREC также помогает быстро обнаружить дефекты в Т-клеточном и В-клеточном звене иммунитета. Эти маленькие фрагменты удаляются из цепи ДНК в процессе созревания Т- и В-клеток. По их количеству можно определить, достаточно ли этих лимфоцитов для нормального функционирования иммунной системы.
Диагностика с помощью инструментальных методов
Помимо этого, пациенту могут назначить УЗИ, компьютерную томографию или рентгенографию, чтобы выяснить, насколько повреждены внутренние органы из-за сбоя иммунитета и сопутствующих заболеваний.
Терапия первичного иммунодефицита
Для пациентов с первичным иммунодефицитом важно избегать заражений и не прививаться живыми вакцинами (против полиомиелита, ветрянки, паротита, кори, туберкулеза). Инфекционные заболевания лечатся антибиотиками, иногда назначают профилактические курсы антибактериальной терапии. При нехватке защитных антител пациентам проводят введение иммуноглобулинов, которые повышают иммунитет.
У большинства форм первичного иммунодефицита рекомендуется трансплантация костного мозга или гемопоэтических стволовых клеток, которые организм производит. В последние годы также активно исследуются генные методы лечения первичных иммунодефицитов.
Трансплантация костного мозга
Костный мозг производит гемопоэтические (кроветворные) стволовые клетки, из которых позднее формируются все элементы крови, включая лимфоциты, необходимые для правильной работы иммунной системы. Успешная трансплантация донорского костного мозга или его стволовых клеток «перезапускает» кроветворную систему человека с ПИД, и в организме получателя начинается выработка достаточного количества здоровых лимфоцитов. Обычно это происходит по следующему плану.
Сначала выбирается донор: он должен быть наиболее совместим с получателем, иначе организм получателя отвергнет пересаженные клетки. Совместимость определяется по наличию одинаковых антигенных комплексов системы HLA – индивидуального набора белков-антигенов, находящихся на поверхности клеток и регулирующих иммунный ответ. У донора забирают костный мозг из тазовых костей с помощью специальных игл. Процедура проводится под обезболиванием и абсолютно безболезненна и безопасна даже для детей. Есть и альтернативный метод: донор проходит специальную обработку, после чего в его крови появляется большое количество стволовых клеток. Затем их собирают с помощью специального оборудования.
Для лечения пациентов с ПИД перед трансплантацией часто используется курс химиотерапии. Этот метод позволяет уничтожить кроветворную систему пациента, чтобы предотвратить отторжение иммунной системой нового биоматериала.
После проведения трансплантации пациенту необходимо находиться в стерильном боксе, чтобы исключить риск инфекций. Также ему переливают тромбоконцентрат и эритроцитарную массу, содержащие необходимые клетки для быстрого восстановления кроветворной системы. После успешной процедуры пациент остается под постоянным наблюдением врачей и регулярно проходит осмотры.
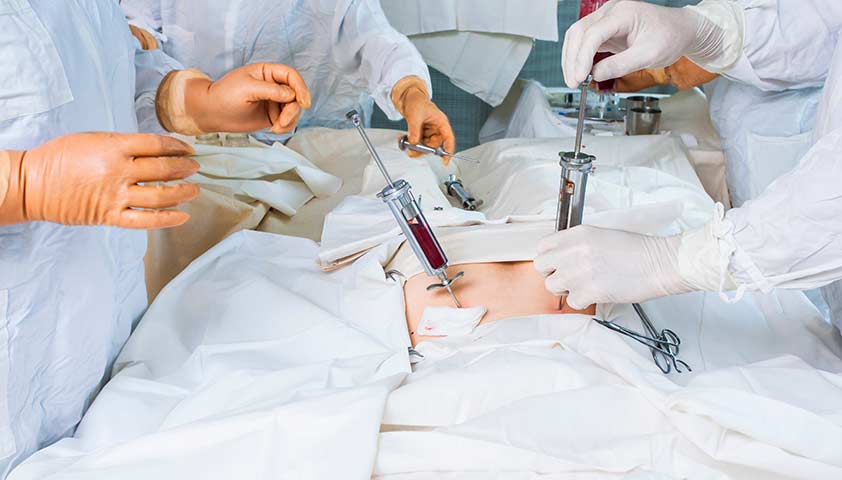
Важно отметить, что родители не могут выступать в роли доноров костного мозга для своих детей. В качестве доноров могут выступать только братья или сестры, совместимые с реципиентом.
Проведение трансплантации костного мозга не всегда приносит желаемый эффект, по данным исследований, в 20-50% случаев иммунная система организма получателя начинает атаковать донорские клетки, интерпретируя их как враждебных агентов, это известно как реакция “трансплантат против хозяина” (РТПХ). В лучшем случае это приводит к тому, что организм возвращается к изначальному состоянию иммунодефицита. В худшем случае клетки начинают нападать на сами себя, что напоминает аутоиммунное заболевание. Для подавления РТПХ применяют специальные препараты, действующие на иммунную систему.
Генная терапия
Процедура генной терапии также включает в себя замену стволовых клеток, однако они не берутся от донора, а из самого организма пациента. У человека с первичным иммунодефицитом (ПИД) производят сбор стволовых клеток и при помощи вируса вводят в них здоровую копию гена, дефект которого привел к иммунодефицитному состоянию. Обработанный биоматериал затем пересаживается обратно пациенту. Такой метод терапии исключает необходимость трансплантации костного мозга, однако в данном случае существует риск возникновения лейкемии, вызванной вирусами, используемыми для передачи здорового гена. В настоящее время данная терапия включает в себя экспериментальные методы и не применима для всех видов ПИД, однако в будущем, вероятно, сможет заменить пересадку костного мозга.
Перспективы первичного иммунодефицита
Результаты прогноза различаются в зависимости от формы заболевания, скорости постановки диагноза и начала лечения. У детей с тяжелыми комбинированными иммунодефицитами благоприятный исход возможен, если правильный диагноз был установлен в первые 3 месяца жизни и успешно проведена трансплантация костного мозга. В этом случае шансы на выживание ребенка составляют 90–95%. Однако без необходимой терапии 98% детей с этим диагнозом умирают в первые 2 года жизни.
Пациенты с дефектом комплемента или дефицитом антител в большинстве случаев имеют благоприятный прогноз при ранней диагностике и адекватной терапии. Однако у пациентов с ошибками клеточного иммунитета и иммунодефицитами, ассоциированными с синдромальными проявлениями, прогноз зависит от множества факторов.
Способы профилактики первичного иммунодефицита
Нельзя предотвратить первичные иммунодефициты, так как они обусловлены генетическими нарушениями, на которые нельзя повлиять.
Для снижения вероятности рождения ребенка с ПИД, будущие родители могут пройти генетический скрининг перед зачатием, чтобы выявить распространенные мутации. Это особенно важно для тех, у кого в семье были случаи наследственных заболеваний, включая иммунодефициты.
Оценка вероятности врожденных заболеваний, включая синдромы, связанные с первичным иммунодефицитом, улучшают неинвазивные методы обследования плода: комбинированный скрининг во время 1-го и 2-го триместров, а также НИПТ – неинвазивные пренатальные тесты. При повышенном риске развития наследственных и генетических заболеваний проводят инвазивные исследования с использованием хориональных ворсин и околоплодной жидкости для точного уточнения диагноза.
Наиболее сложные формы ПИД – серьезные комбинированные иммунодефициты, а также некоторые другие типы врожденных ошибок иммунитета – удается выявить непосредственно после рождения малыша с помощью тестов TREC и KREC. Исследование включено в обязательный скрининг новорожденных в США. Раннее обнаружение этих заболеваний повышает шансы на успешное лечение и сохранение качества жизни.
Источники
- Болков М.А., Тузанкина И.А., Шинвари Х.З., Черемохин Д.А. Классификация врожденных ошибок иммунитета человека, обновленная экспертами комитета Международного союза иммунологических обществ в 2019 году/ Российский иммунологический журнал. 2021. №24(1). С. 7–68.
- Первичные иммунодефициты с преимущественной недостаточностью синтеза антител : клинические рекомендации/ Российская ассоциация аллергологов и клинических иммунологов, Национальная ассоциация экспертов в области первичных иммунодефицитов. 2022.
- Фернандез Дж. Обзор иммунодефицитных состояний // MSD. 2023.
- Buckley R. H. Molecular defects in human severe combined immunodeficiency and approaches to immune reconstitution // Annu Rev Immunol. 2004. Vol. 22. P. 625–655. doi:10.1146/annurev.immunol.22.012703.104614
- Bousfiha A., Jeddane L., Picard C., et al. Human Inborn errors of immunity: 2019 Update of the IUIS Phenotypical Classification // J Clin Immunol. 2020. Vol. 40(1). P. 66–81. doi:10.1007/s10875-020-00758-x
- Meyts I., Bousfiha A., Duff C., et al. Primary immunodeficiencies: a decade of progress and a promising future // Front Immunol. 2021. Vol. 18:11. P. 625753. doi:10.3389/fimmu.2020.625753
Иммунодефицитные состояния, аналогичные первичному иммунодефициту
В данном разделе мы рассмотрим состояния, которые имеют сходные с первичным иммунодефицитом признаки и симптомы. Они могут быть вызваны как генетическими, так и приобретенными факторами, что затрудняет диагностику и требует профессионального подхода в определении правильного пути лечения.
| Признак | Первичный иммунодефицит | Сходное состояние |
|---|---|---|
| Нарушение иммунной системы | Генетически обусловленное снижение иммунной активности | Приобретенное иммунодефицитное состояние |
| Частые инфекции | Повышенная чувствительность к инфекциям из-за недостаточного функционирования иммунной системы | Частые бактериальные или вирусные заболевания |
| Неэффективное лечение антибиотиками | Иммунная система не способна эффективно бороться с возбудителями инфекций | Отсутствие результата от стандартной терапии |
При подозрении на иммунодефицитное состояние, сходное с первичным иммунодефицитом, необходима консультация генетика. Только специалист сможет провести все необходимые исследования и определить дальнейшие шаги по диагностике и лечению данного состояния.
Консультация генетика при подозрении на первичный иммунодефицит
| Как проводится консультация генетика: |
| Генетик проводит сбор анамнеза и изучает медицинскую историю пациента для выявления наличия родственников с иммунодефицитами или другими генетическими заболеваниями. |
| Осуществляется генетическое тестирование, которое позволяет выявить наличие конкретных генетических мутаций, связанных с иммунодефицитом. |
| Проводится генетическое консультирование, в рамках которого генетик объясняет пациенту и его семье результаты тестирования, а также возможные риски наследования заболевания. |
Консультация генетика при подозрении на первичный иммунодефицит помогает определить генетическую природу заболевания и разработать индивидуальный план лечения и превентивных мероприятий. Генетический анализ может также быть полезен для прогнозирования возможных осложнений и рекомендаций по ведению здорового образа жизни.
Инновационные методы лечения первичного иммунодефицита
В данном разделе мы рассмотрим новаторские подходы к лечению первичного иммунодефицита, направленные на улучшение качества жизни пациентов и повышение их иммунной защиты.
| Иммунотерапия | Иммунотерапия – это метод лечения, основанный на активации или модуляции иммунной системы пациента с целью борьбы с инфекциями и повышения ее эффективности. |
| Трансплантация костного мозга | Трансплантация костного мозга является одним из способов лечения первичного иммунодефицита, позволяя заменить дефективные клетки иммунной системы здоровыми. |
| Генная терапия | Генная терапия – перспективное направление, позволяющее внедрить здоровые гены в клетки пациента для коррекции наследственных нарушений иммунной системы. |
Использование инновационных методов лечения первичного иммунодефицита позволяет улучшить состояние пациентов и предотвратить возможные осложнения, связанные с иммунодефицитом.
Видео по теме:
Вопрос-ответ:
Какие органы и ткани входят в иммунную систему?
В иммунную систему входят лимфатическая система, тимус, костный мозг, вилочковая железа, миндалины, аппендикс, селезёнка.
Когда начинают формироваться основные элементы иммунной системы?
Основные элементы иммунной системы начинают формироваться на 13-й неделе внутриутробного развития.
Что такое антитела и какую роль они играют в организме?
Антитела, или иммуноглобулины, являются особыми белками, которые вырабатываются В-лимфоцитами. Они служат для нейтрализации патогенов, уничтожения вирусов и бактерий, а также активизации других элементов иммунной системы.
Какие функции выполняют лимфоциты, вырабатываемые костным мозгом?
Лимфоциты, особые виды лейкоцитов, уничтожают патогены и синтезируют антитела для защиты организма от болезнетворных микробов и инородных клеток.
Какие органы помогают в обеспечении иммунной защиты у человека?
Кроме костного мозга, в иммунную систему вовлечены тимус, вилочковая железа, миндалины, аппендикс и селезёнка, которые играют ключевую роль в защите организма от болезнетворных агентов.
На каком этапе начинают формироваться основные элементы иммунной системы?
Основные элементы иммунной системы начинают формироваться на 13-й неделе внутриутробного развития.